MiS elimina una úlcera diabética crónica: un caso clínico
Tras haber sido probada y utilizada ampliamente en el tratamiento de heridas con resultados apreciables, la Laserterapia MLS®, a través del dispositivo MiS, también ha dado resultados positivos en el tratamiento de un caso de úlcera diabética crónica.
La acción concomitante de dos longitudes de onda diferentes con la elevada potencia de pico característica del equipo produce efectos analgésicos, antiinflamatorios y antiedematosos, que han demostrado ser importantes para el manejo eficaz de la patología y para facilitar la reparación de los tejidos superficiales y profundos.
Lo confirma el caso de una paciente de 65 años que padece diabetes mellitus tipo II y que presenta una úlcera crónica en el tobillo derecho causada por la patología. Sometida inicialmente sin resultados apreciables a terapia farmacológica y supervisión especialista, la paciente fue luego sometida a Laserterapia MLS®: 20 sesiones (4 por semana con duración de 2 minutos cada una) con el dispositivo MiS (protocolo “herida superficial”), seguidas de una medicación simple, produjeron una clara mejoría de la úlcera después de las primeras sesiones, hasta su cierre completo al final del ciclo.
Los seguimientos posteriores, cada 1 y 2 meses, demostraron también la restauración completa de la barrera cutánea y la ausencia de inflamaciones.
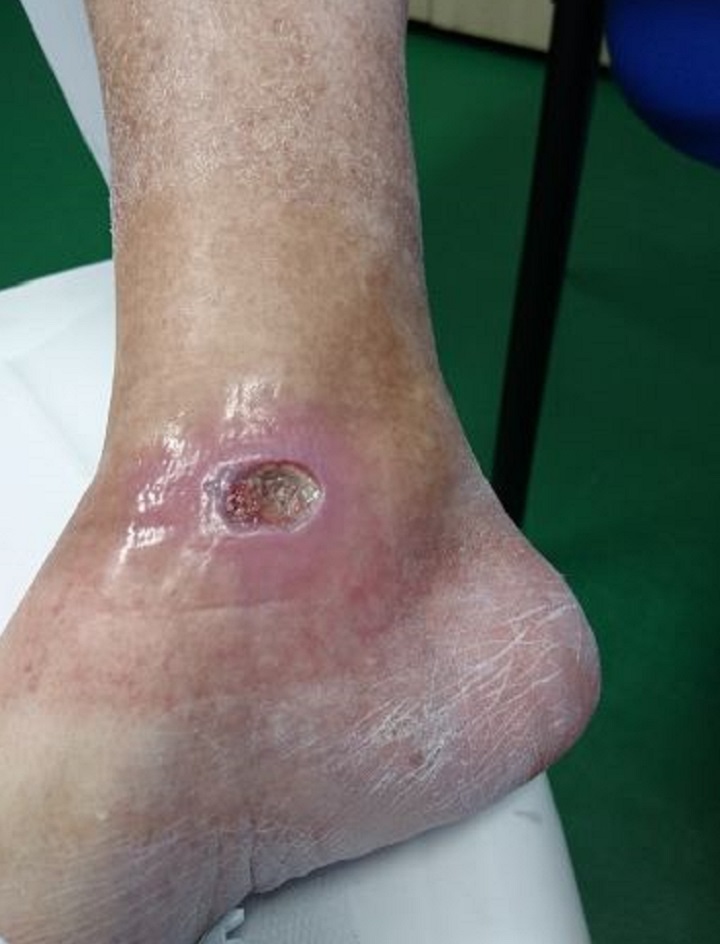
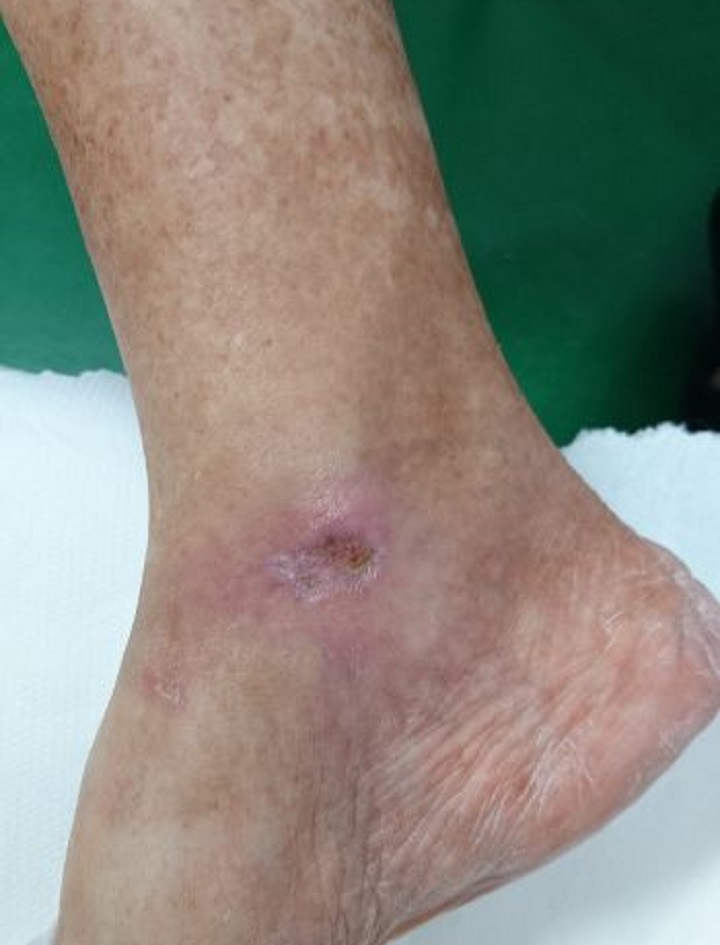
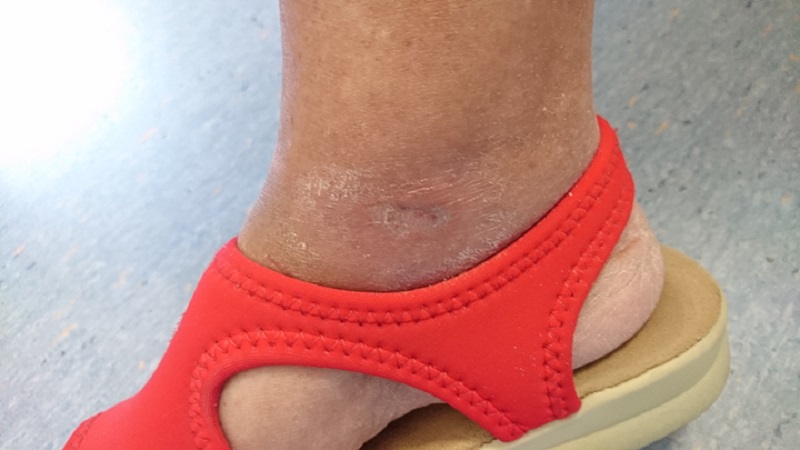
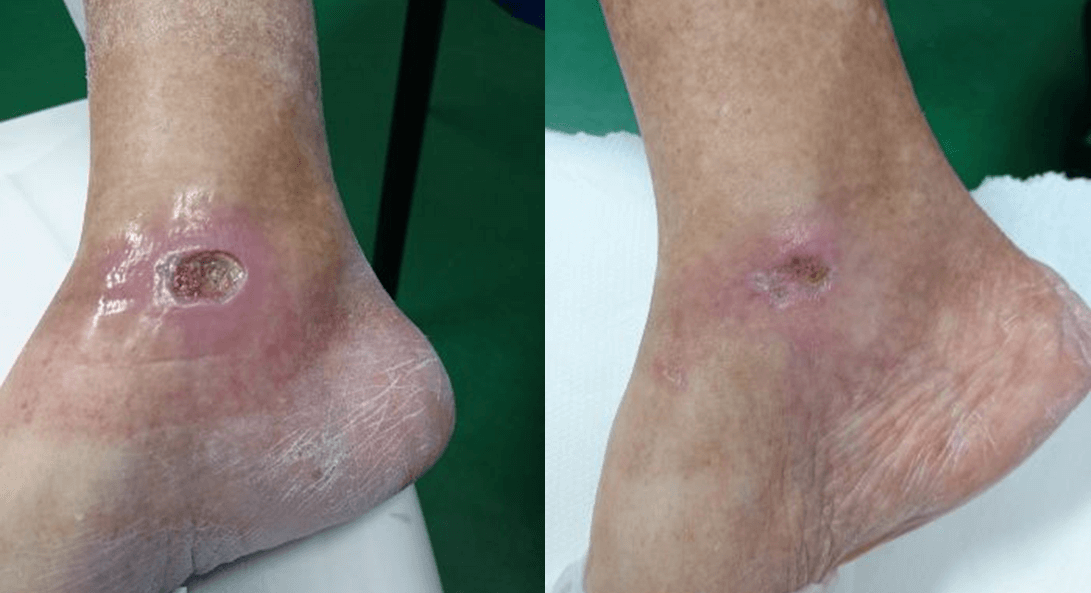
“Healing of Leg Diabetic ulcer treated with MLS-MiS laser (MiS – MLS® High Peak Pulse): a case report”
T. Viliani, B. Lombardi
Energy For Health [21], 2021