MiS dà scacco ad un’ulcera diabetica cronica: un caso clinico
12 Ottobre 2021 - Ricerca -
Condividi
Dopo essere stata sperimentata e largamente utilizzata nel trattare con risultati apprezzabili le ferite, la Laserterapia MLS®, attraverso il dispositivo MiS, ha dato risultati positivi anche nell’affrontare un caso di ulcera diabetica cronica.
L’azione concomitante di due diverse lunghezze d'onda con elevata potenza di picco caratteristica dell’apparecchiatura produce infatti effetti analgesici, antinfiammatori, antiedemigeni, che si sono dimostrati importanti per la gestione efficace della patologia e per facilitare la riparazione dei tessuti superficiali e profondi.
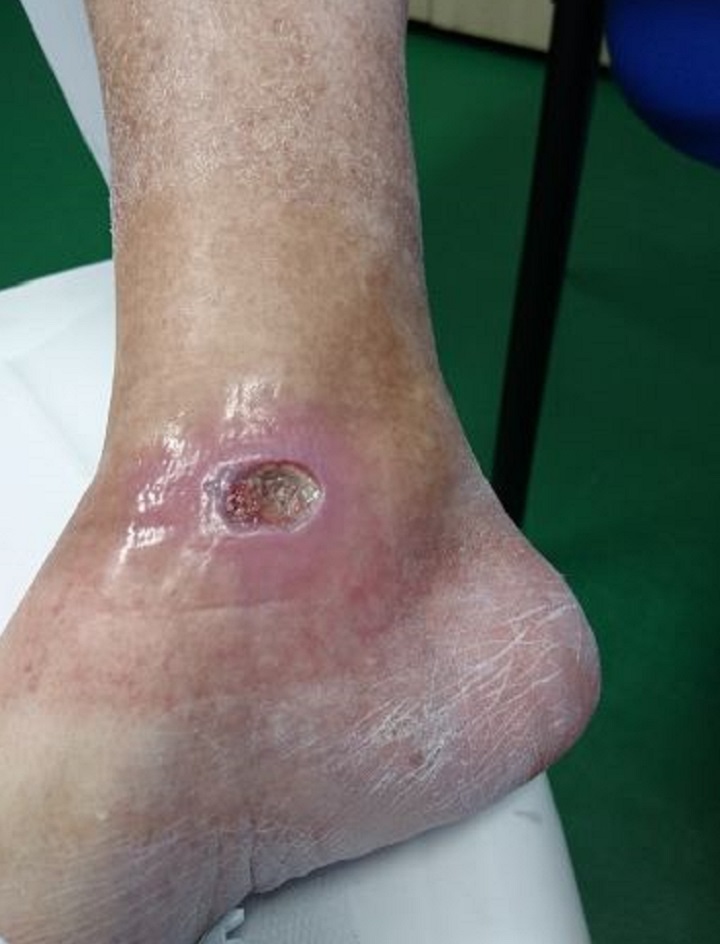
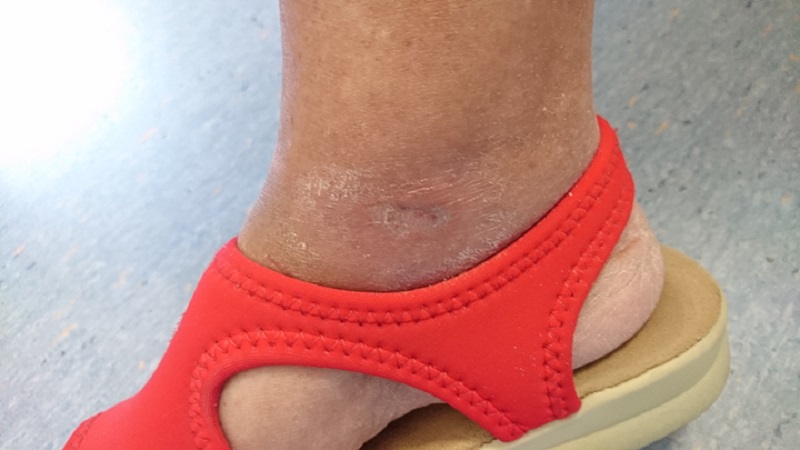
Ne dà riscontro il caso di una paziente di 65 anni affetta da diabete mellito di tipo II con un’ulcera cronica alla caviglia destra causata dalla patologia.
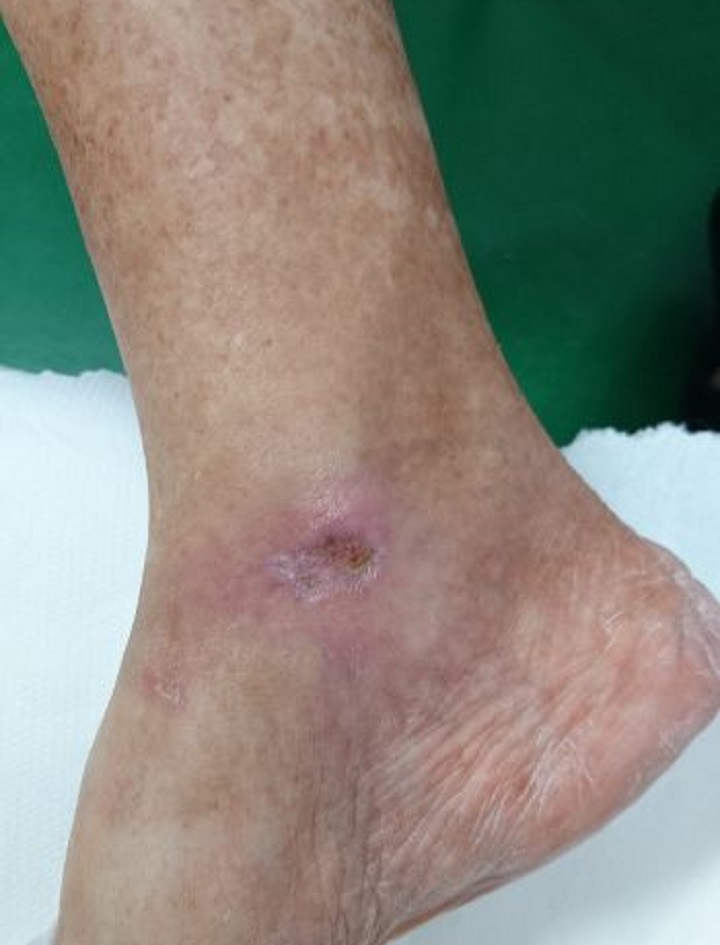
Inizialmente sottoposta senza risultati apprezzabili a terapia farmacologica e a sorveglianza specialistica, la paziente è stata quindi sottoposta a Laserterapia MLS®: 20 sedute (4 a settimana della durata ciascuna di 2 minuti) con il dispositivo MiS (protocollo “ferita superficiale”), seguite da una semplice medicazione, hanno prodotto già dopo le prime sessioni un evidente miglioramento dell’ulcera, sino alla sua completa chiusura al termine del ciclo.
I successivi follow up, a distanza di 1 e 2 mesi, hanno inoltre evidenziato una totale ripristino della barriera cutanea e assenza di infiammazioni.
Testo a Destra
Immagine 30%/Testo 60%
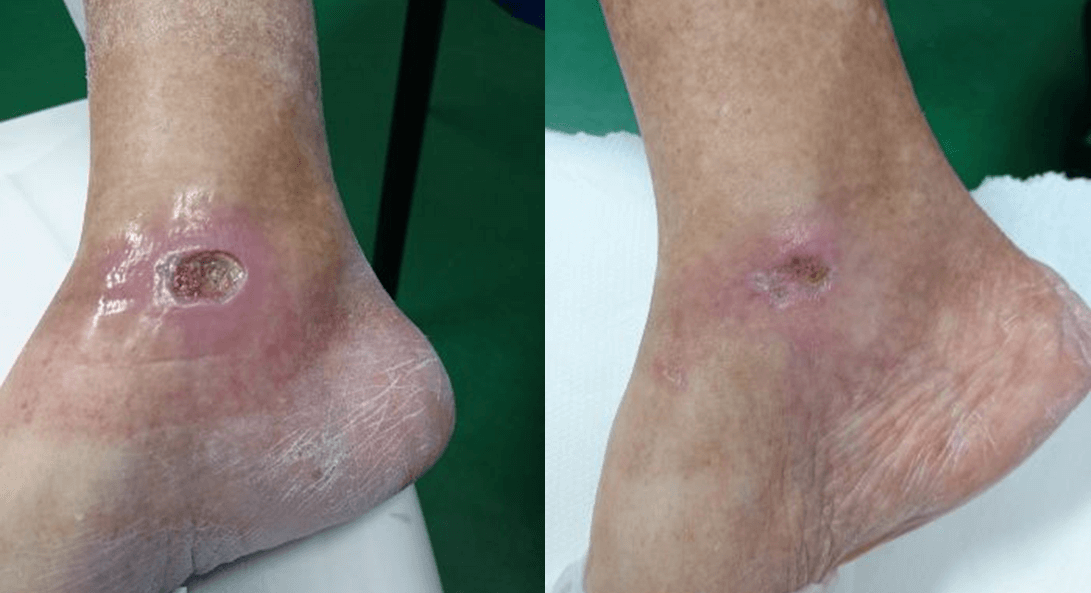
“Healing of Leg Diabetic ulcer treated with MLS-MiS laser (MiS – MLS® High Peak Pulse): a case report”
T. Viliani, B. Lombardi
Energy For Health [21], 2021