MiS besiegt ein chronisches diabetisches Geschwür: ein klinischer Fall
12 Oktober 2021 - Forschung -
Share
Nachdem die MLS®-Lasertherapie mit dem MiS-Gerät getestet und weit verbreitet bei der Behandlung von Wunden mit bemerkenswerten Ergebnissen eingesetzt wurde, hat sie auch positive Ergebnisse bei der Behandlung eines chronischen diabetischen Ulkus erzielt.
Die gleichzeitige Wirkung von zwei verschiedenen Wellenlängen mit hoher Spitzenleistung, die für das Gerät charakteristisch ist, erzeugt schmerzstillende, entzündungshemmende und ödemhemmende Wirkungen, die sich für die wirksame Behandlung der Krankheit als wichtig erwiesen haben und die Reparatur von oberflächlichen und tiefen Geweben fördert.
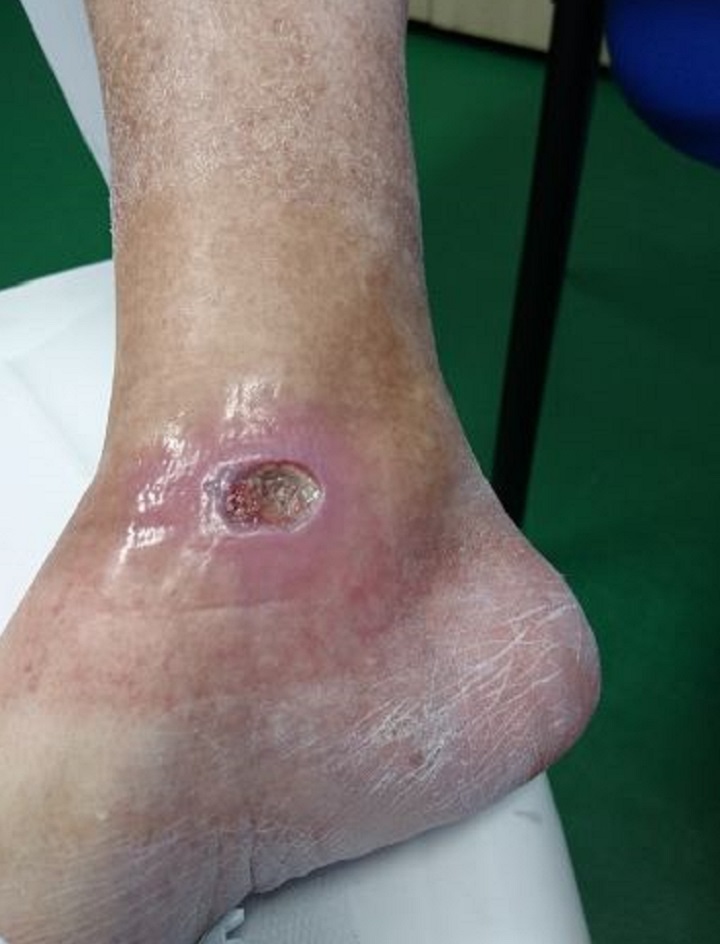
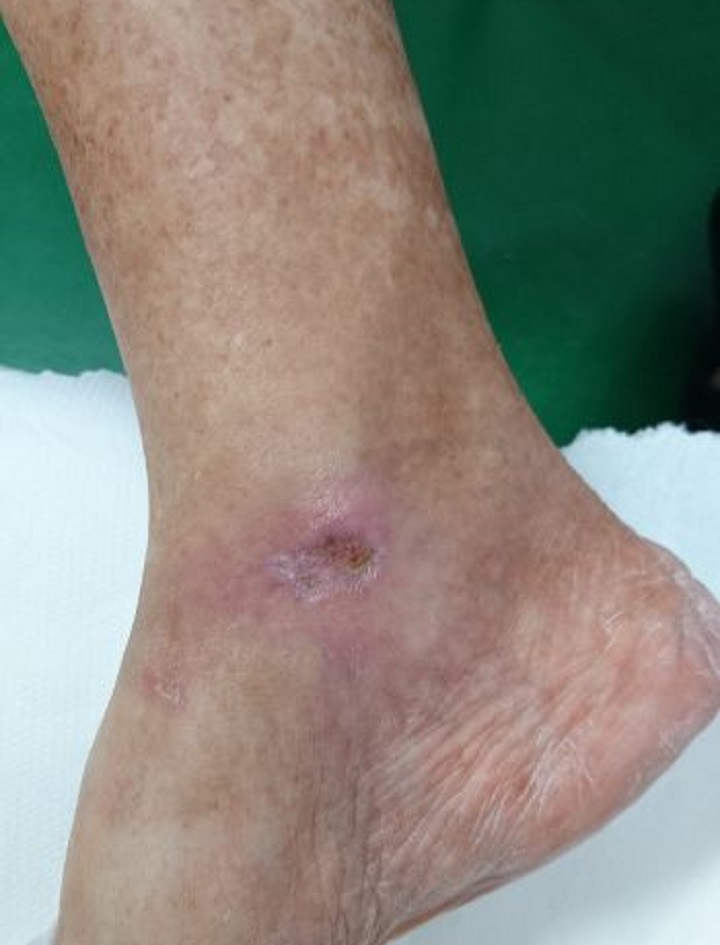
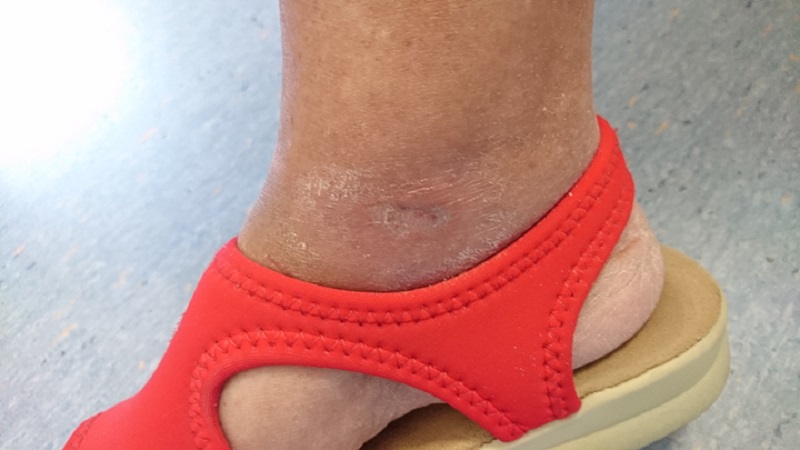
Dies wird durch den Fall einer 65-jährigen Patientin mit Diabetes mellitus Typ II und einem krankheitsbedingten chronischen Ulkus am rechten Sprunggelenk bestätigt. Sie wurde zunächst ohne nennenswerte Ergebnisse einer medikamentösen Therapie und einer Überwachung durch Spezialisten unterzogen. Daraufhin wurde die MLS®-Lasertherapie in Erwägung gezogen: 20 Sitzungen (4 pro Woche mit jeweils 2 Minuten) mit dem MiS-Gerät (Protokoll „oberflächliche Wunde“), gefolgt von einer einfachen Wundversorgung. Bereits nach den ersten Sitzungen konnte eine deutliche Besserung des Geschwürs bis zum vollständigen Verschluss am Ende des Zyklus festgestellt werden.
Die anschließenden Nachuntersuchungen nach 1 und 2 Monaten zeigten ebenfalls eine vollständige Wiederherstellung der Hautbarriere und das Fehlen von Entzündungen.
Testo a Destra
Immagine 30%/Testo 60%
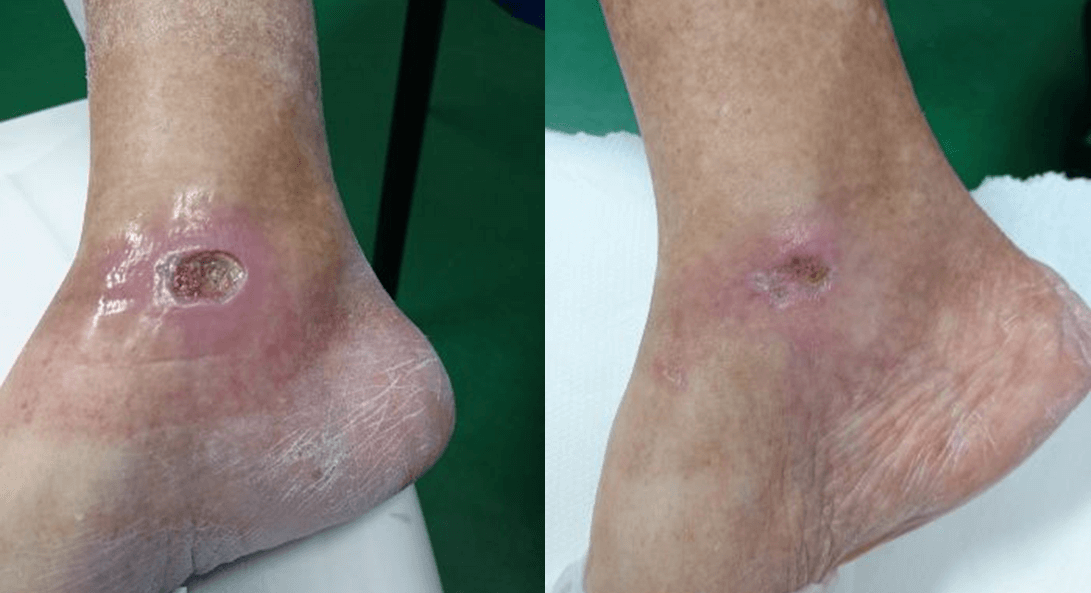
“Healing of Leg Diabetic ulcer treated with MLS-MiS laser (MiS – MLS® High Peak Pulse): a case report”
T. Viliani, B. Lombardi
Energy For Health [21], 2021