MiS checkmates a chronic diabetic ulcer: a clinical case
After having been tried and widely used for treating wounds with appreciable results, MLS® Laser Therapy with the MiS device provided positive results also when treating a chronic diabetic ulcer.
The simultaneous action of two different wavelengths with high peak power which characterise the equipment in fact produces analgesic, anti-inflammatory and anti-oedema effects which proved to be important for effectively managing the disease and for facilitating healing of both superficial and deep tissues.
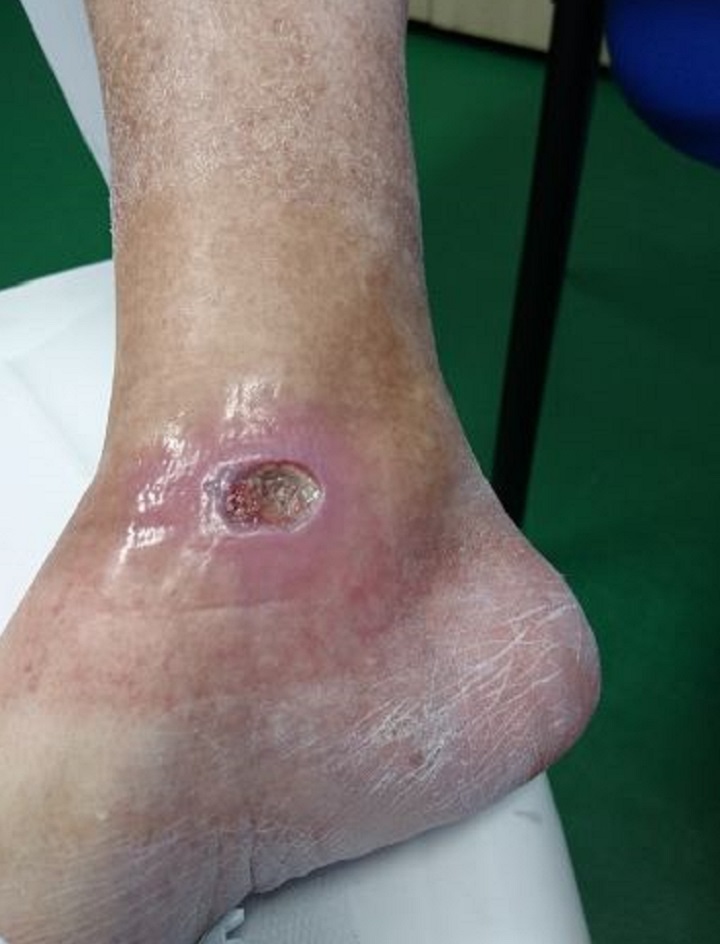
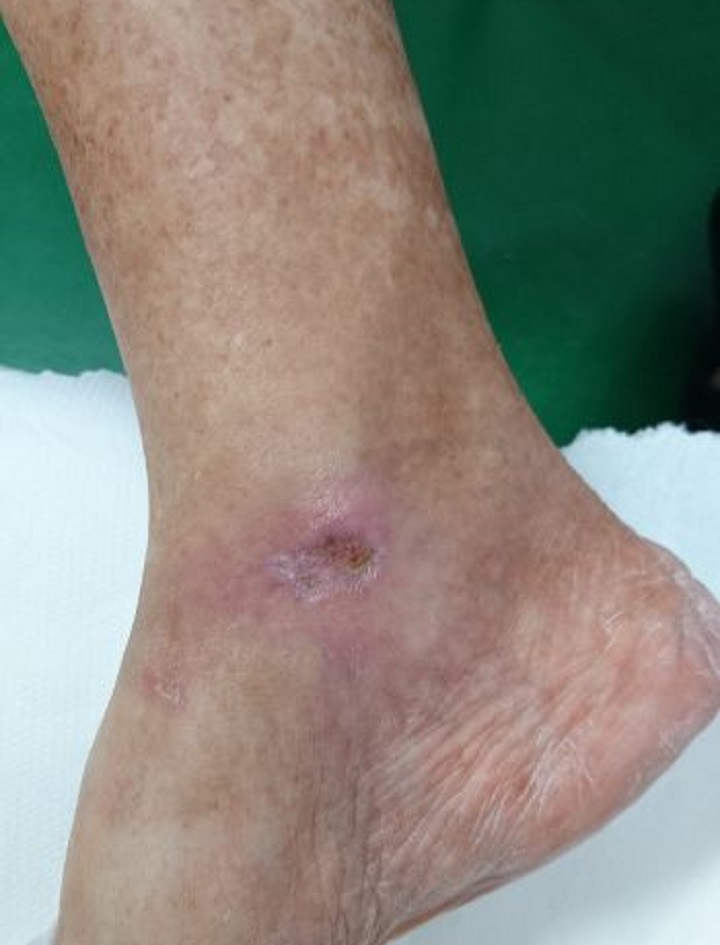
This is confirmed by a 65-year old patient suffering from type 2 diabetes with a chronic ulcer to the right ankle caused by the disease. Initially undergoing drug therapy and dedicated surveillance with no appreciable results, the patient then underwent MLS® Laser Therapy: 20 sessions (4 per week lasting 2 minutes each) with the MiS device (“superficial wound” protocol), followed by simple medication, which after just a few sessions led to an evident improvement in the ulcer, up to its complete closure at the end of the cycle.
Furthermore, subsequent follow-ups at 1 and 2 months showed a full recovery of the skin barrier and the absence of inflammation.
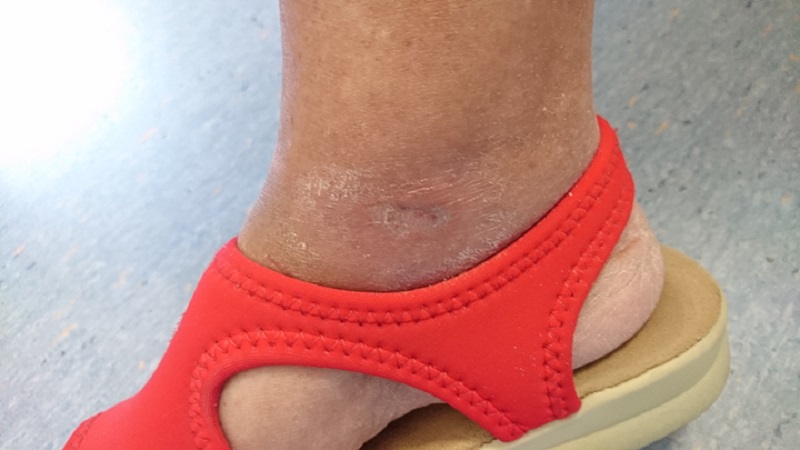
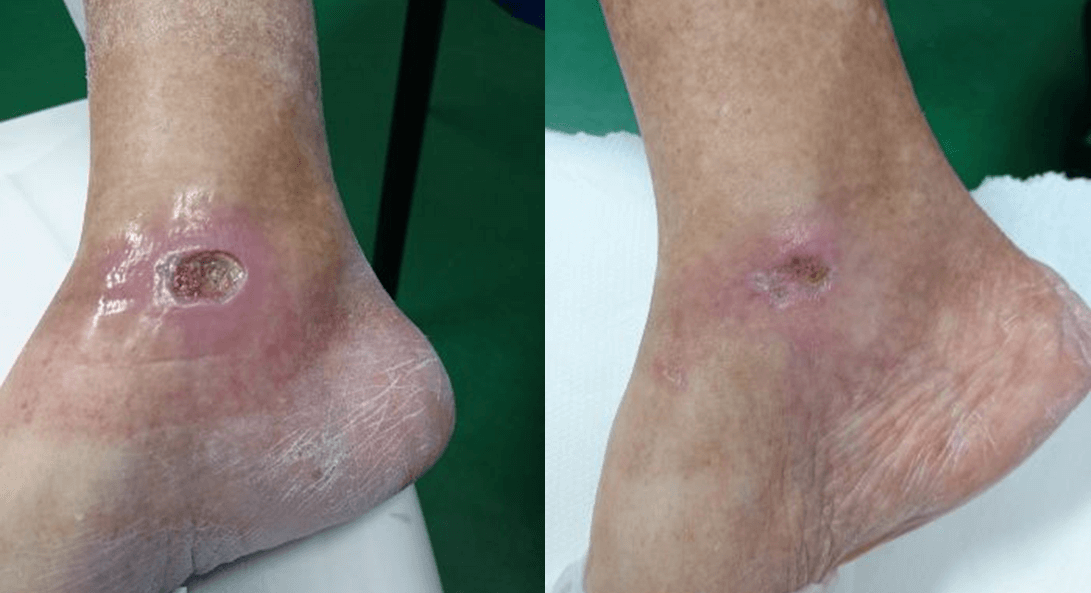
“Healing of Leg Diabetic ulcer treated with MLS-MiS laser (MiS – MLS® High Peak Pulse): a case report”
T. Viliani, B. Lombardi
Energy For Health [21], 2021