MLS® Laser Therapy and Bell’s palsy: a study on effectiveness
A study published in Lasers in Medical Science investigated the efficacy of MLS® Laser Therapy in patients with acute unilateral facial paralysis thanks to the M6 robotic device.
Bell's palsy: what is it?
- Bell's palsy is the most common cause of acute unilateral facial paralysis, with an average incidence of 15-30 cases per 100,000.
- It is caused by a dysfunction of the facial nerve, the VII cranial nerve. This nerve is responsible for the innervation of all facial muscles involved in facial expression.
- Bell's palsy determines a marked weakness of the facial muscles on one side of the face, as well as: asymmetry of the smile caused by one corner of the mouth drooping, inability to close the eyelids, disappearance of wrinkles on the forehead, reduced stimulation of lacrimal and salivary glands.
- The symptoms occur suddenly - they peak in as little as 72 hours - and are usually asymptomatic.
- The drugs that are commonly used to treat it are corticosteroids - to reduce inflammation and swelling - and analgesics for the pain.
- Physiotherapy - especially if started within the first 72 hours after the onset of symptoms - is essential to stimulate the facial nerve and help it maintain good muscle tone.
The study
“Effectiveness of multiwave locked system laser on the treatment of patients with idiopathic Bell's palsy: a randomized double-blind placebo controlled trial.” is a recent spontaneous study published in Lasers in Medical Science [vol. 37,9 (2022):3495-3502] aimed at investigating the treatment of patients affected by Bell's palsy by exploiting the characteristics of the M6 robotic device for MLS® Laser Therapy. Although the publication in question is based on a randomised, double-blind placebo controlled trial, this field of application is still being investigated and studied.
Specifically, the 60 patients enrolled were divided into 3 groups:
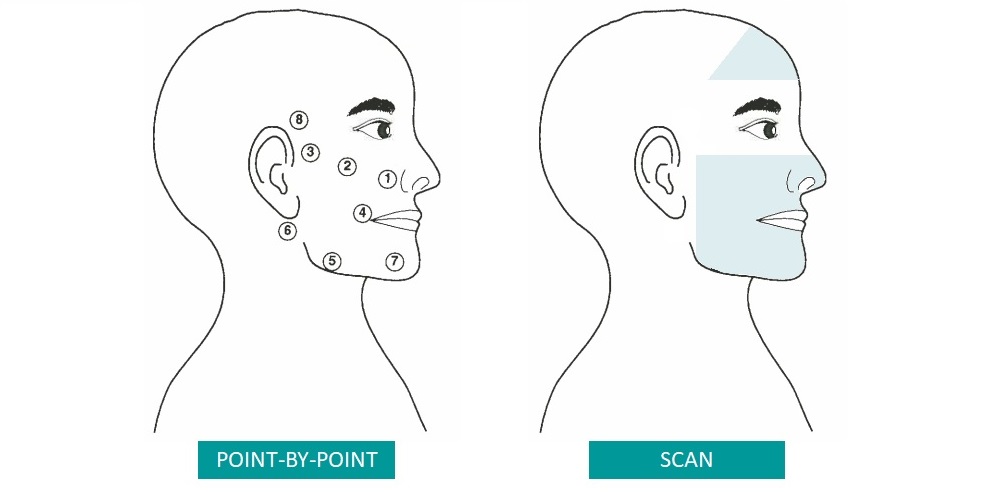
- Group A – MLS® scanning + massages + exercises
- Group B – spot MLS® + massages + exercises
- Group C – Sham-Laser + massages + exercises
Il ciclo di trattamento ha previsto 2 sedute a settimana per 6 settimane.
The treatment cycle consisted of 2 sessions per week for 6 weeks.
Each patient was assessed at the beginning, halfway through the cycle (after 3 weeks and 6 sessions) and at the end of the treatment cycle (after 6 weeks and 12 sessions).
The House-Brakman Scale (HBS) and the Facial Disability Index (FDI), consisting of two subscales - the Physical Facial Disability Index (PFDI) and the Social Facial Disability Index (SFDI) - were used to quantify the effects of laser therapy.
The results
The results showed that MLS® Laser Therapy, combined with massages and facial exercise, leads to a significant improvement at the end of the treatment cycle compared to the patient's initial condition.
Already after 6 sessions – halfway though the treatment cycle – patients treated with MLS®, both in scanning and in spot mode, showed significant improvement in terms of motor and social function (Facial Disability Index) and degree of facial nerve paralysis (House–Brackmann Scale).
When compared to the control group (Sham-Laser), MLS® Laser Therapy showed significant superiority. In particular, scanning application showed a significant effect compared to both the control group and spot application.