M6 in the prevention of peripheral neuropathy caused by chemotherapy: a study
NEUROLASER is the name of the recent pilot study carried out by a team of researchers from the medical faculty of Hasselt University in collaboration with doctors from the departments of Oncology and Neurology of the Jessa Hospital (Hasselt, Belgium).
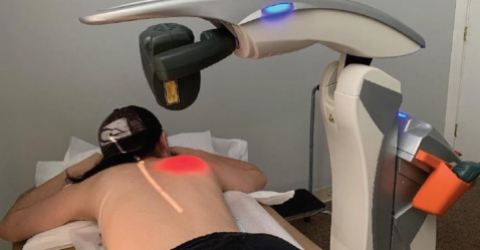
The clinical trial investigated the efficacy and safety of photobiomodulation therapy (PBMT) delivered by laser source (M6) in the prevention of chemotherapy-induced peripheral neuropathy (CIPN) in patients with breast cancer.
The team, led by Dr. Robijns, involved 32 patients in the study, of which 16 underwent PBMT while 16 were given placebo treatment.
The data collected revealed promising results in terms of prevention. Symptoms such as numbness of the hands and feet worsened significantly in the control group, while they remained constant in the group treated with PMB. The quality of life in treated patients also improved compared to the control patients. All the laser therapy treatments were shown to be safe and free from undesirable effects.
To confirm the applicability and effectiveness of laser therapy in the prevention of peripheral neuropathies induced by chemotherapy, further studies are required, which will contribute to increasing the number of cases. However, this preliminary study provides encouraging results on the possibility of applying the M6 system in supportive therapies for cancer patients, as already highlighted by previous experiences related to the treatment of radiodermatitis.

“The use of photobiomodulation therapy for the prevention of chemotherapy-induced peripheral neuropathy: a randomized, placebo-controlled pilot trial (NEUROLASER trial)”
Supportive Care Cancer, Mar 21;1-9, 2022