M6 dans la prévention de la neuropathie périphérique causée par la chimiothérapie: une étude
NEUROLASER est le nom de la récente étude pilote réalisée par une équipe de la faculté de médecine de l’Université de Hasselt en collaboration avec les médecins des départements d’Oncologie et Neurologie de l'Hôpital Jessa (Hasselt, Belgique).
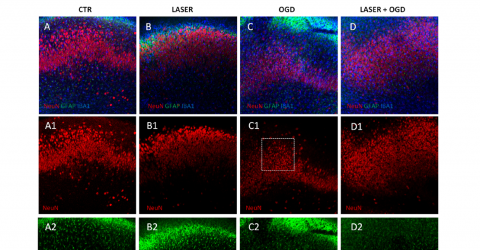
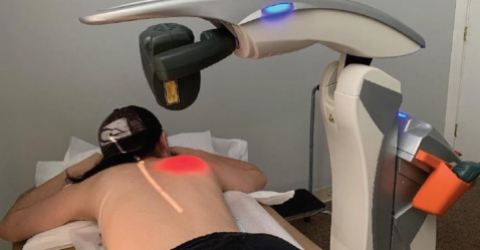
L’essai clinique a évalué l’efficacité et la sécurité de la thérapie de photobiomodulation (PBMT) émise par la source laser (M6) dans la prévention de la neuropathie périphérique induite par la chimiothérapie (CIPN) chez des patientes avec un cancer du sein.
Cette étude, menée par l’équipe du Dr. Robijns, a impliqué 32 patients, dont 16 ont été soumis à la PBMT et 16 à un traitement placebo.
Les données recueillies montrent des résultats prometteurs en termes de prévention. Des symptômes, comme l’engourdissement des mains et des pieds, ont significativement empiré dans le groupe contrôle, alors qu’ils sont restés constants dans le groupe traité avec la PMB. Les patients traités ont aussi vu leur qualité de vie améliorée par rapport à celle des patients du groupe contrôle. Tous les traitements via la thérapie laser se sont avérés sûrs et sans effets indésirables.
Pour confirmer l’applicabilité et l’efficacité de la thérapie laser dans la prévention des neuropathies périphériques induites par la chimiothérapie, il faudra mener des études supplémentaires, qui permettront d’augmenter la casuistique. Néanmoins, cette étude préliminaire fournit des résultats encourageants sur la possibilité d’appliquer le système M6 dans les thérapies d’appoint aux patients oncologiques, comme déjà mis en évidence par des expériences précédentes liées au traitement des radiodermatites.

“The use of photobiomodulation therapy for the prevention of chemotherapy-induced peripheral neuropathy: a randomized, placebo-controlled pilot trial (NEUROLASER trial)”
Supportive Care Cancer, Mar 21;1-9, 2022