MLS® in prima linea nel trattamento della sindrome dolorosa subacromiale
18 Marzo 2021 - Ricerca -
Condividi
Una recente ricerca - The Short-Term Outcomes of Multiwave Locked System (MLS) Laser Therapy versus a Combination of Transcutaneous Nerve Stimulation and Ultrasound Treatment for Subacromial Pain Syndrome – condotta su un numero significativo di pazienti affetti da sindrome dolorosa subacromiale (SAPS) ha messo in evidenza l’efficacia di MLS® nel suo trattamento.
A seguito infatti dell’applicazione della Laserterapia MLS® si è assistito a:
- miglioramento della funzionalità
- riduzione del dolore
- riduzione della disabilità nel breve termine
Per giungere a questo risultato, 47 persone con questa patologia sono state suddivise in due gruppi corrispondenti ad altrettante soluzioni terapeutiche: i 22 pazienti che componevano il primo gruppo sono stati sottoposti a 10 sedute di 5 minuti ciascuna di MLS® con a corollario alcuni esercizi, mentre i restanti 25 del secondo sono stati oggetto di sessioni di TENS/ultrasuoni e attività fisica.
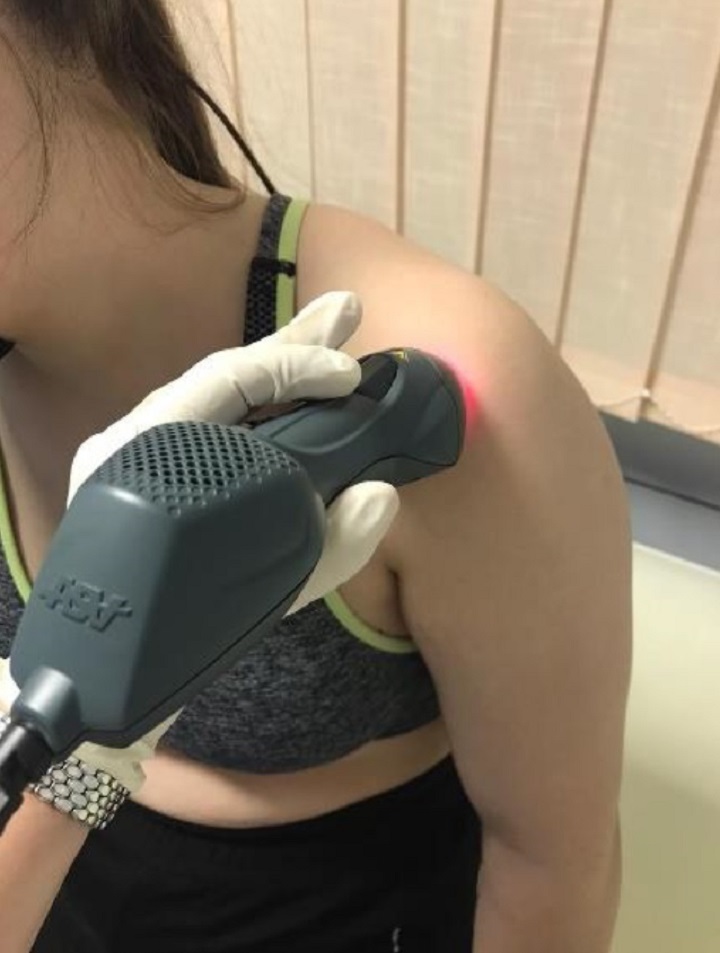
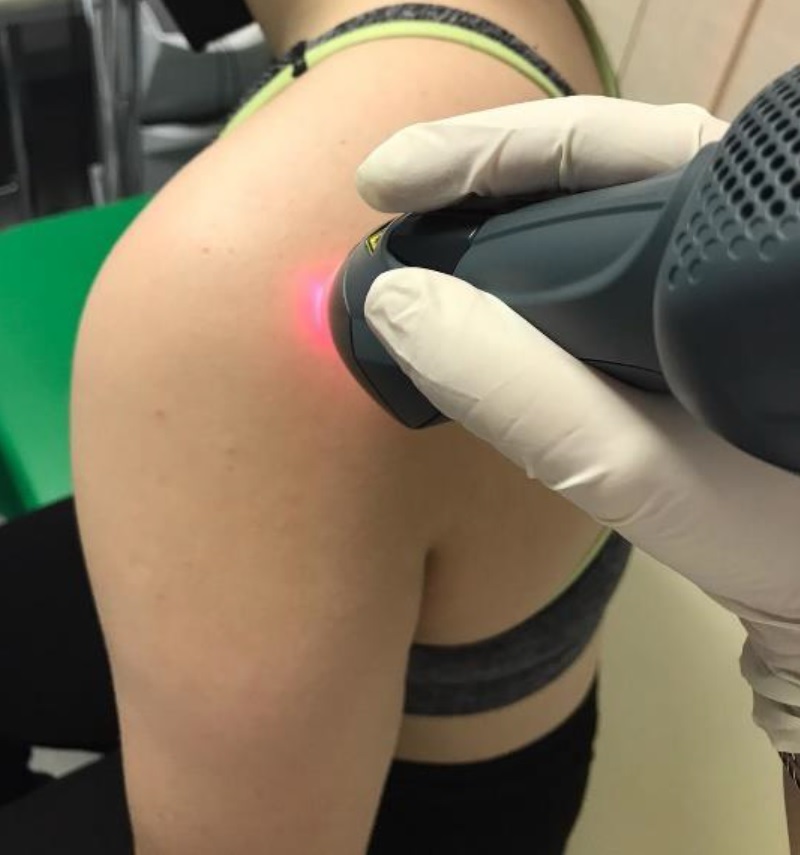
Per valutare gli esiti delle due terapie, prima del trattamento e a distanza di 15 giorni dal termine dei cicli di cura, sono stati rilevati i valori di 3 parametri emblematici: VAS (dolore), CSS score (funzionalità), SPADI score (dolore e disabilità).
Max 980px
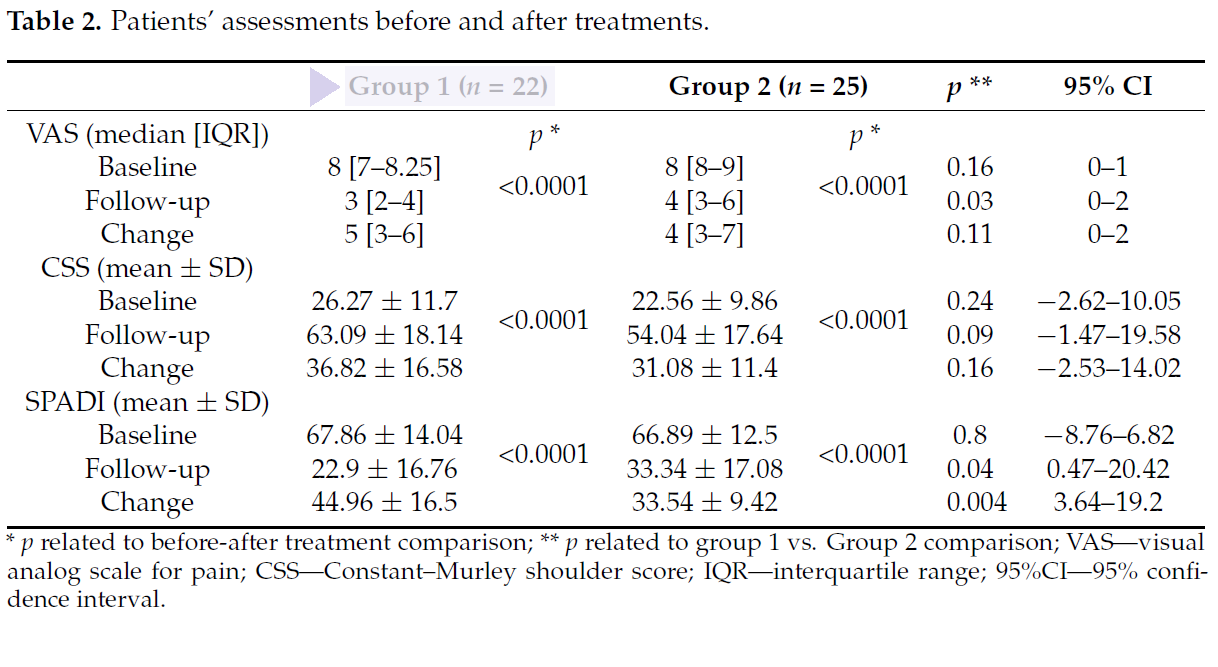
Se ne è concluso che, sebbene entrambi i regimi di trattamento si siano dimostrati idonei e validi, Laserterapia MLS® in combinazione con esercizi di terapia fisica ha attestato punteggi significativamente migliori per VAS e SPADI rispetto all’altra soluzione combinata (TENS/ultrasuoni ed esercizio fisico).