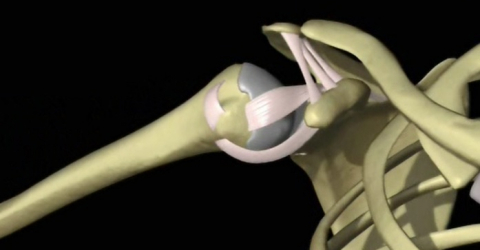
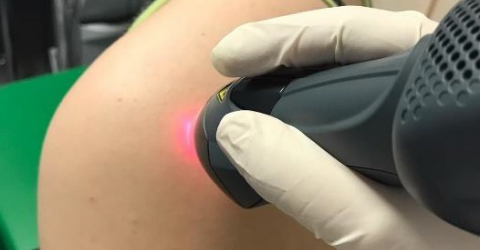
MLS® en primera línea en el tratamiento del síndrome doloroso subacromial
Una reciente investigación - The Short-Term Outcomes of Multiwave Locked System (MLS) Laser Therapy versus a Combination of Transcutaneous Nerve Stimulation and Ultrasound Treatment for Subacromial Pain Syndrome – realizada en un número significativo de pacientes afectados por el síndrome doloroso subacromial (SAPS) ha puesto en evidencia la eficacia de la MLS® en su tratamiento.
De hecho, tras la aplicación de la Laserterapia MLS® se verificó:
- mejoría de la funcionalidad
- reducción del dolor
- reducción de la discapacidad a corto plazo
Para llegar a este resultado, se dividió a 47 personas con esta patología en dos grupos correspondientes a otras tantas soluciones terapéuticas: los 22 pacientes que componían el primer grupo fueron sometidos a 10 sesiones de 5 minutos cada una de MLS® con un corolario de algunos ejercicios, mientras que los 25 restantes del segundo grupo fueron sometidos a sesiones de TENS/ultrasonido y actividad física.
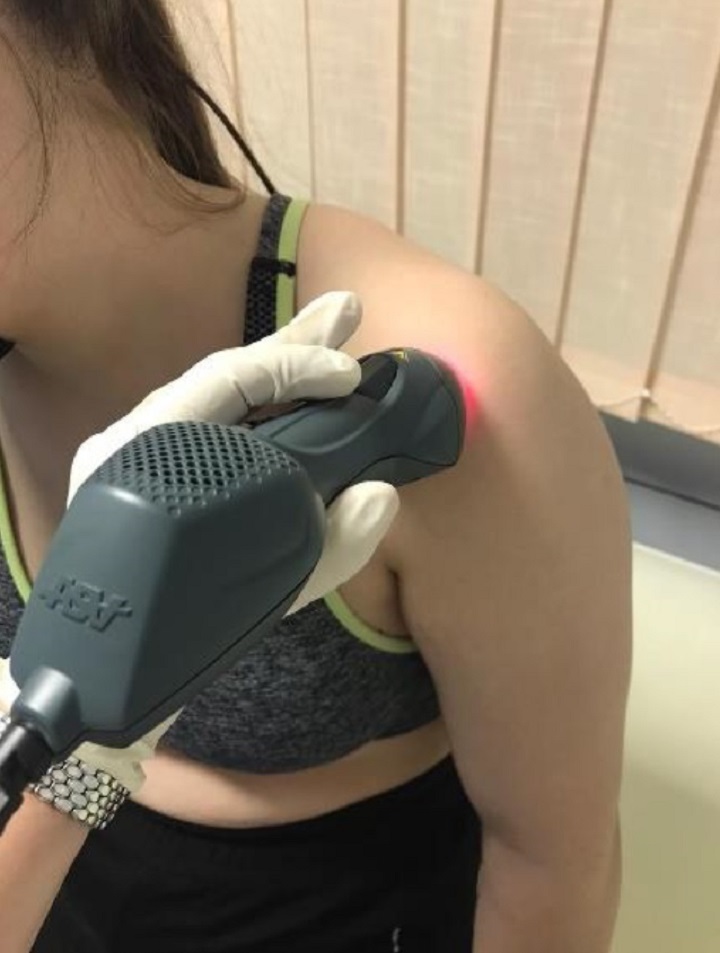
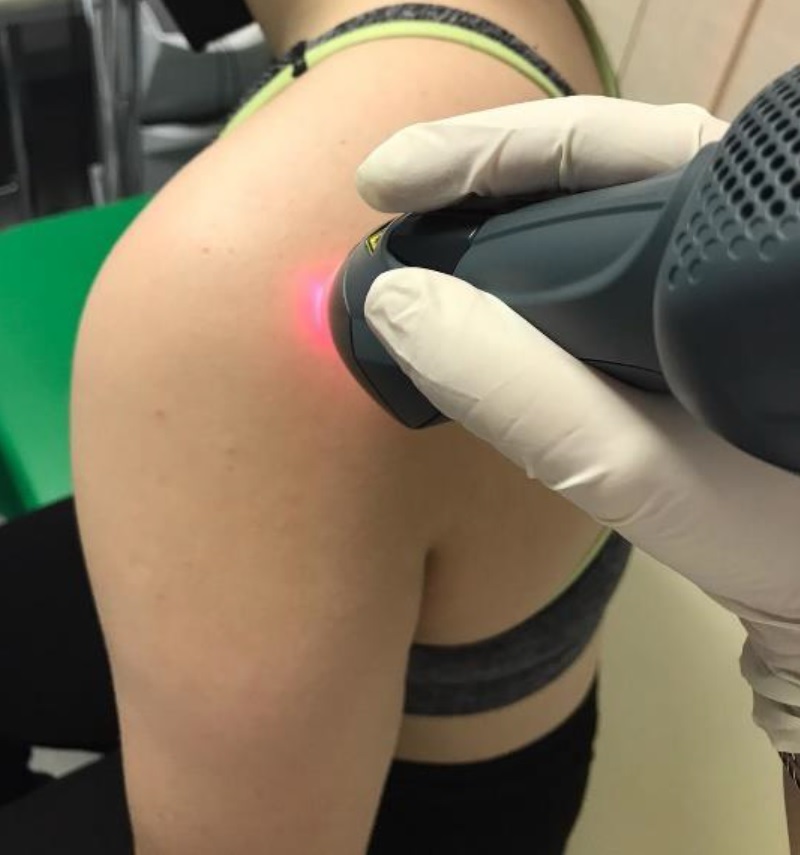
Para evaluar los resultados de las dos terapias, antes del tratamiento y 15 días después del final de los ciclos de tratamiento, se detectaron los valores de 3 parámetros emblemáticos: VAS (dolor), puntuación CSS (funcionalidad), puntuación SPADI (dolor y discapacidad).
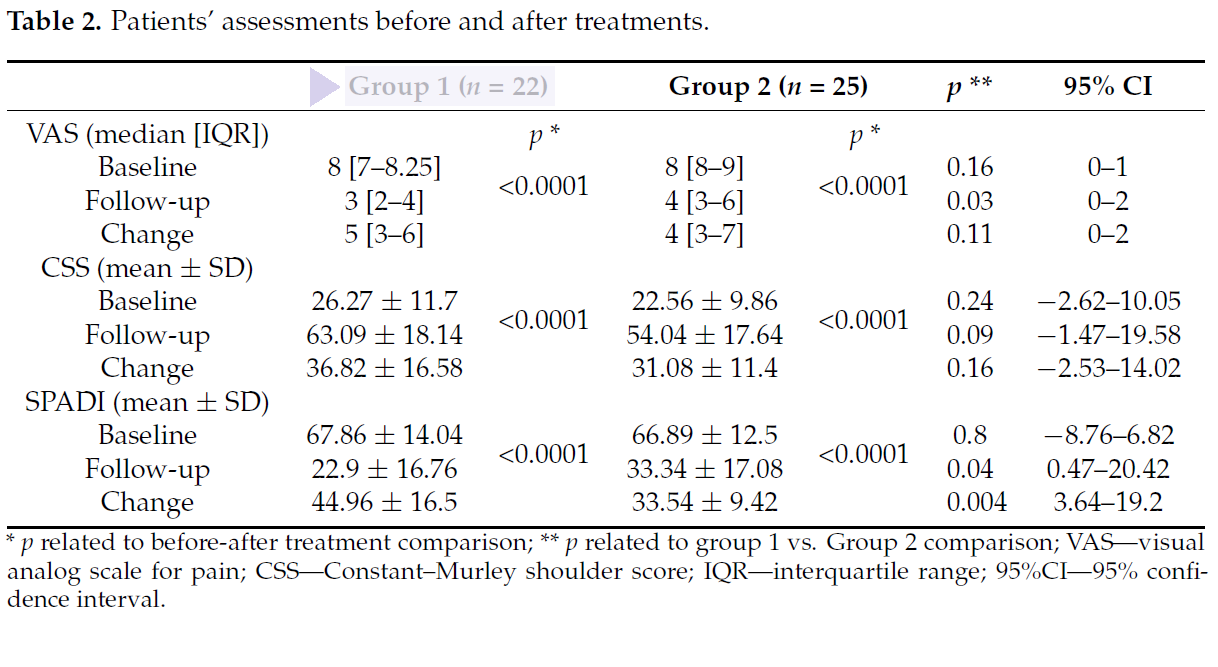
Se llegó a la conclusión de que, aunque ambos tratamientos demostraron ser adecuados y válidos la Laserterapia MLS® en combinación con ejercicios de terapia física mostró puntuaciones significativamente mejores para VAS y SPADI respecto a la otra solución combinada (TENS/ultrasonidos y ejercicio físico).