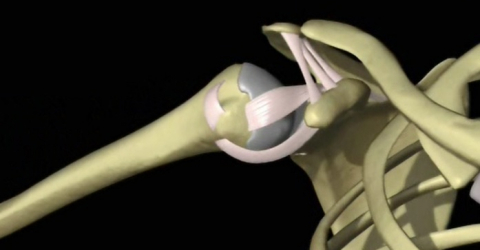
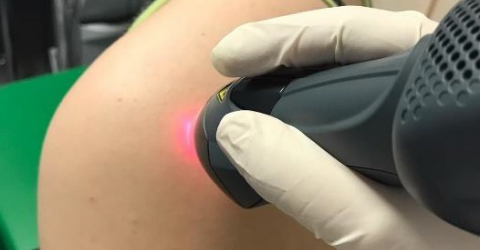
MLS® führend in der Behandlung des subakromialen Schmerzsyndroms
18 März 2021 - Forschung -
Share
Ein kürzlich durchgeführtes Forschungsprojekt - The Short-Term Outcomes of Multiwave Locked System (MLS) Laser Therapy versus a Combination of Transcutaneous Nerve Stimulation and Ultrasound Treatment for Subacromial Pain Syndrome – mit einer großen Anzahl an Patienten, die vom subakromialen Schmerzsyndrom (SAPS) zeigte die Wirksamkeit von MLS® bei der Behandlung auf.
Infolge der Anwendung der MLS®-Lasertherapie konnte Folgendes beobachtet werden:
- Verbesserung der Funktionalität
- Reduktion der Schmerzen
- Reduktion von Bewegungseinschränkungen innerhalb kurzer Zeit
Um dieses Ergebnis zu erzielen, wurden 47 Personen, die an der Erkrankung leiden, in zwei Gruppen mit zwei unterschiedlichen Therapien aufgeteilt: Die 22 Patienten der ersten Gruppe wurden 10 Sitzungen von je 5 Minuten mit MLS® unterzogen und mussten einige Übungen durchführen, während die übrigen 25 Personen der zweiten Gruppe Sitzungen mit TENS/Ultraschall und physischer Aktivität unterzogen wurden.
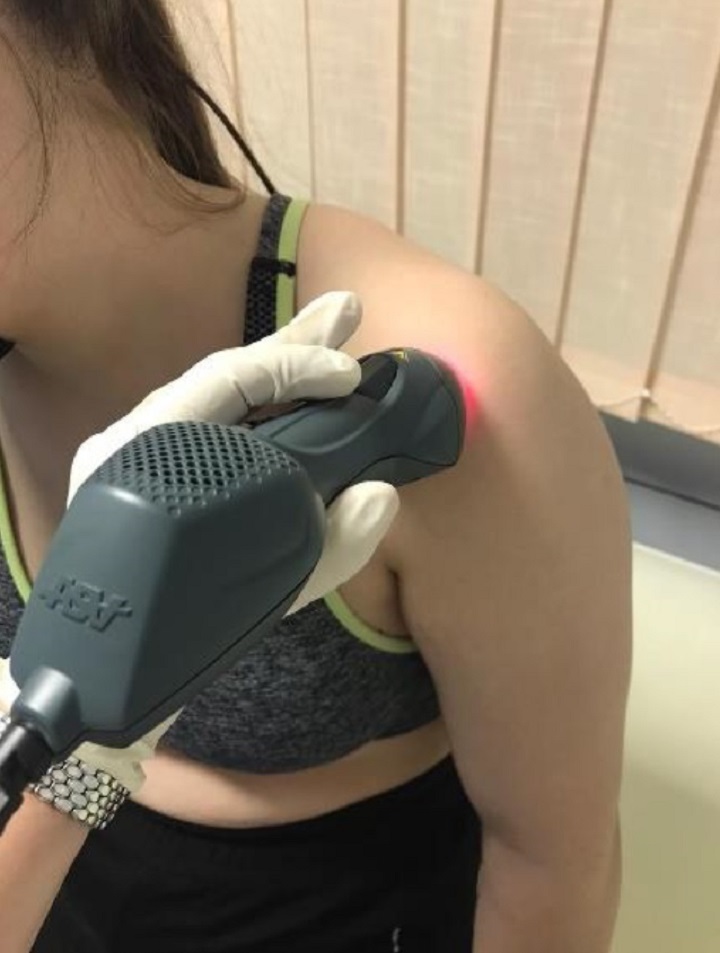
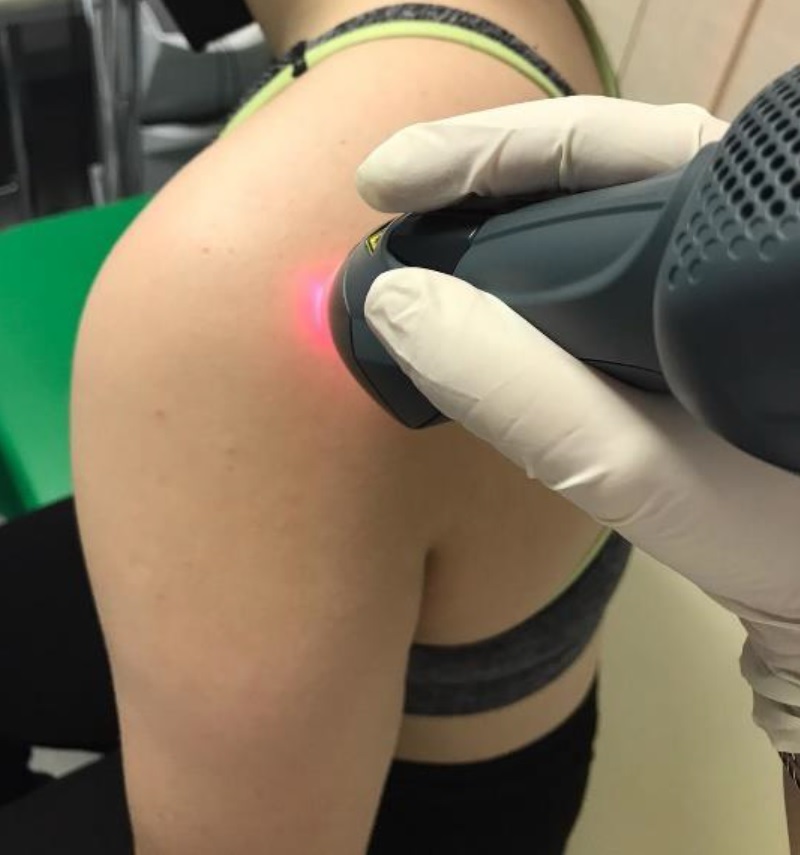
Um die Ergebnisse der beiden Therapieformen vor der Behandlung und 15 Tage nach Beendigung der Behandlungszyklen zu bewerten, wurden die Werte von 3 ausschlaggebenden Parametern überwacht: VAS (Schmerzskala), CSS-Score (Funktionalität) und SPADI-Score (Schmerzen und Bewegungseinschränkungen).
Max 980px
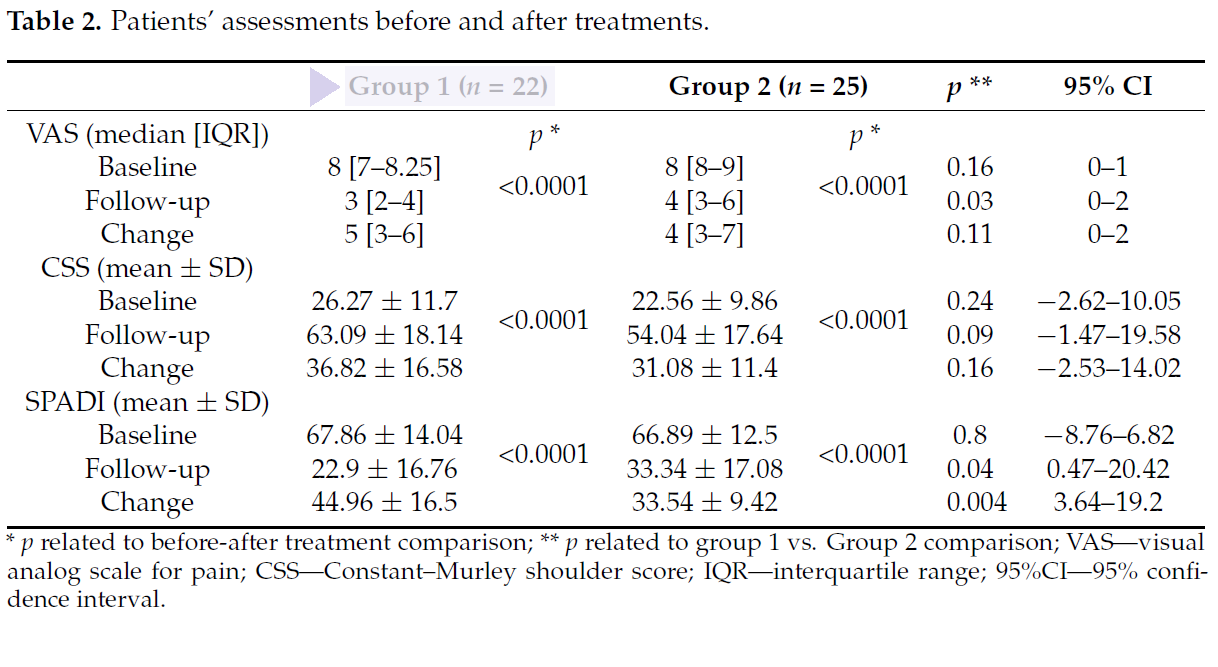
Dabei konnte festgestellt werden, dass beide Behandlungsarten geeignet und valide sind, mit der MLS®-Lasertherapie jedoch in Kombination mit physiotherapeutischen Übungen im Vergleich zur anderen Therapie (TENS/Ultraschall und Bewegung) deutlich höhere Scores betreffend VAS und SPADI erzielt werden können.