MLS® et COVID-19 : nouveau succès dans le traitement de la pneumonie interstitielle
Un nouveau cas confirme l’efficacité de MLS® comme thérapie de support dans le traitement de la pneumonie causée par la COVID-19.
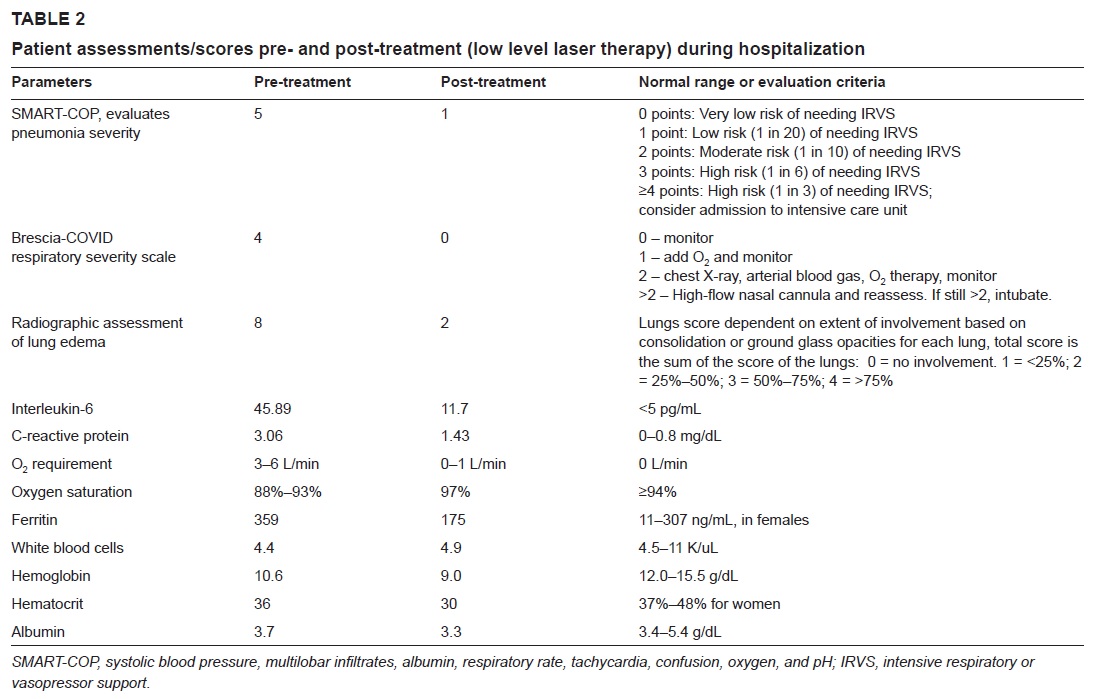
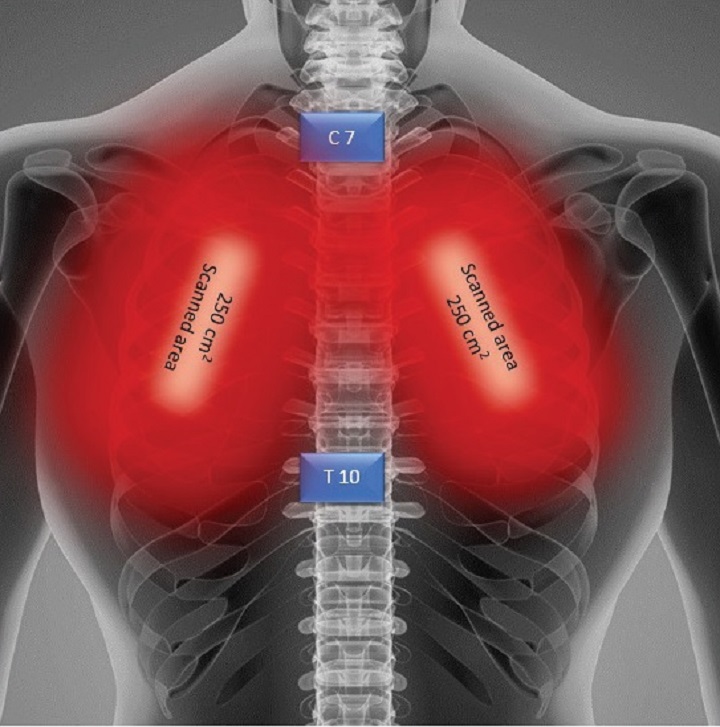
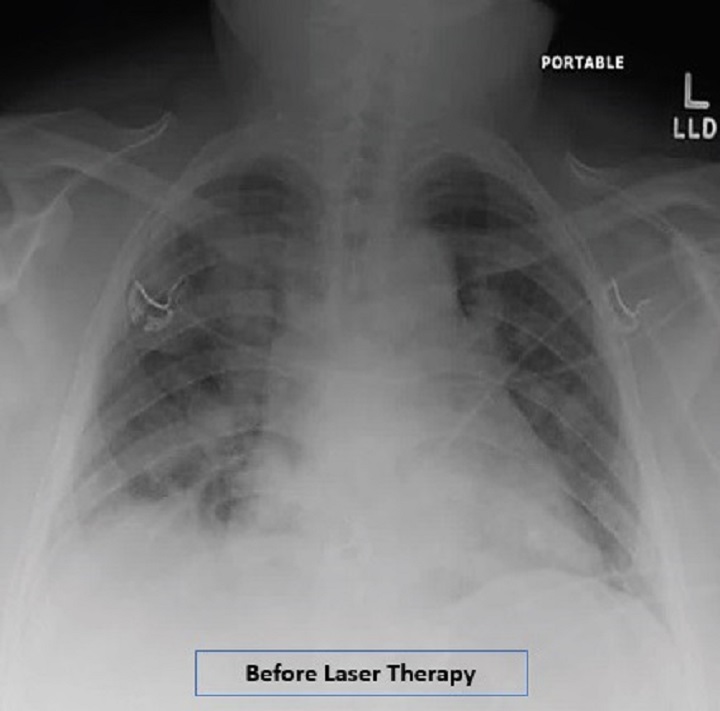
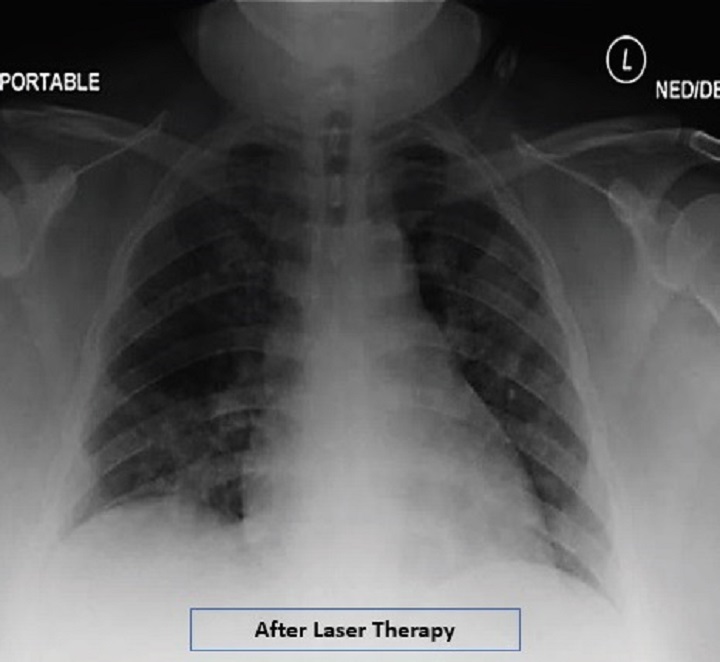
Une patiente obèse avec pneumonie interstitielle, soignée pendant 4 jours avec la Thérapie Laser MLS®, a vu une amélioration concrète et progressive de paramètres critiques comme la saturation d'oxygène, augmentée à 97-99%, la réduction de 8 à 2 de l'évaluation radiographique de l'œdème pulmonaire (RALE), la diminution de 4 à 0 du Brescia COVID (échelle de gravité de la pneumonie qui sert à la gestion par phases des patients) et le passage de 5 à 1 du SMART-COP (valeur qui surveille la gravité de la pneumonie et prévoit la nécessité d'interventions comme par exemple le passage aux soins intensifs etc.).
L’interleukine-6, la ferritine et la protéine C-réactive aussi ont enregistré une baisse sensible.
Les données sont reportées dans l'étude “Adjunct low level laser therapy (LLLT) in a morbidly obese patient with severe COVID-19 pneumonia: A case report” qui, dans ses conclusions, indique comment l'utilisation de la Thérapie Laser MLS® dans le cas en question ait fait enregistrer en quelques jours, des améliorations dans les indices respiratoires, dans les résultats radiologiques et dans les marqueurs inflammatoires.
Un résultat qui suggère comment la thérapie d'ASA puisse être combinée en toute sécurité avec le traitement conventionnel chez les patients avec une grave COVID-19 et une obésité pathologique.