Lungenentzündung infolge von Covid–19 und MLS®: ein erfolgreiches Fallbeispiel
24 August 2020 - Forschung -
Share
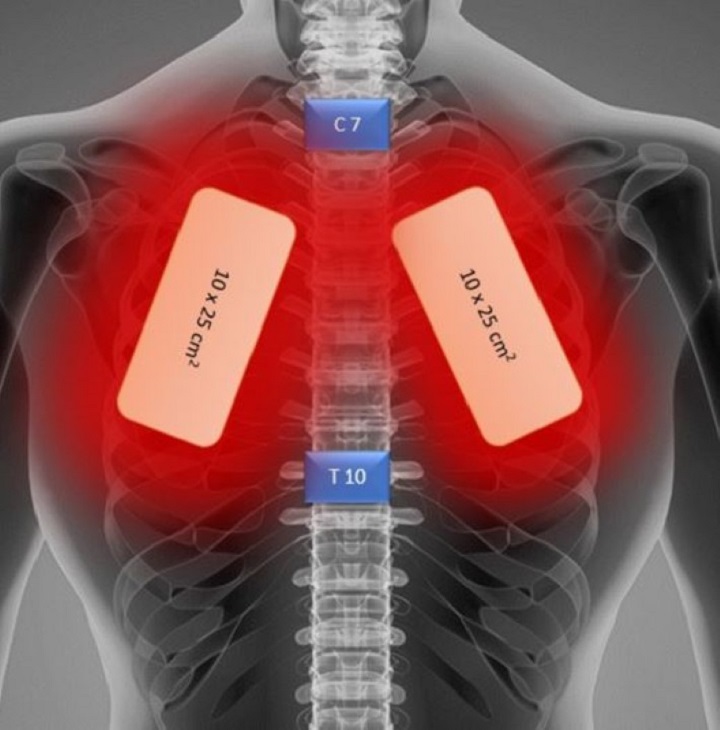
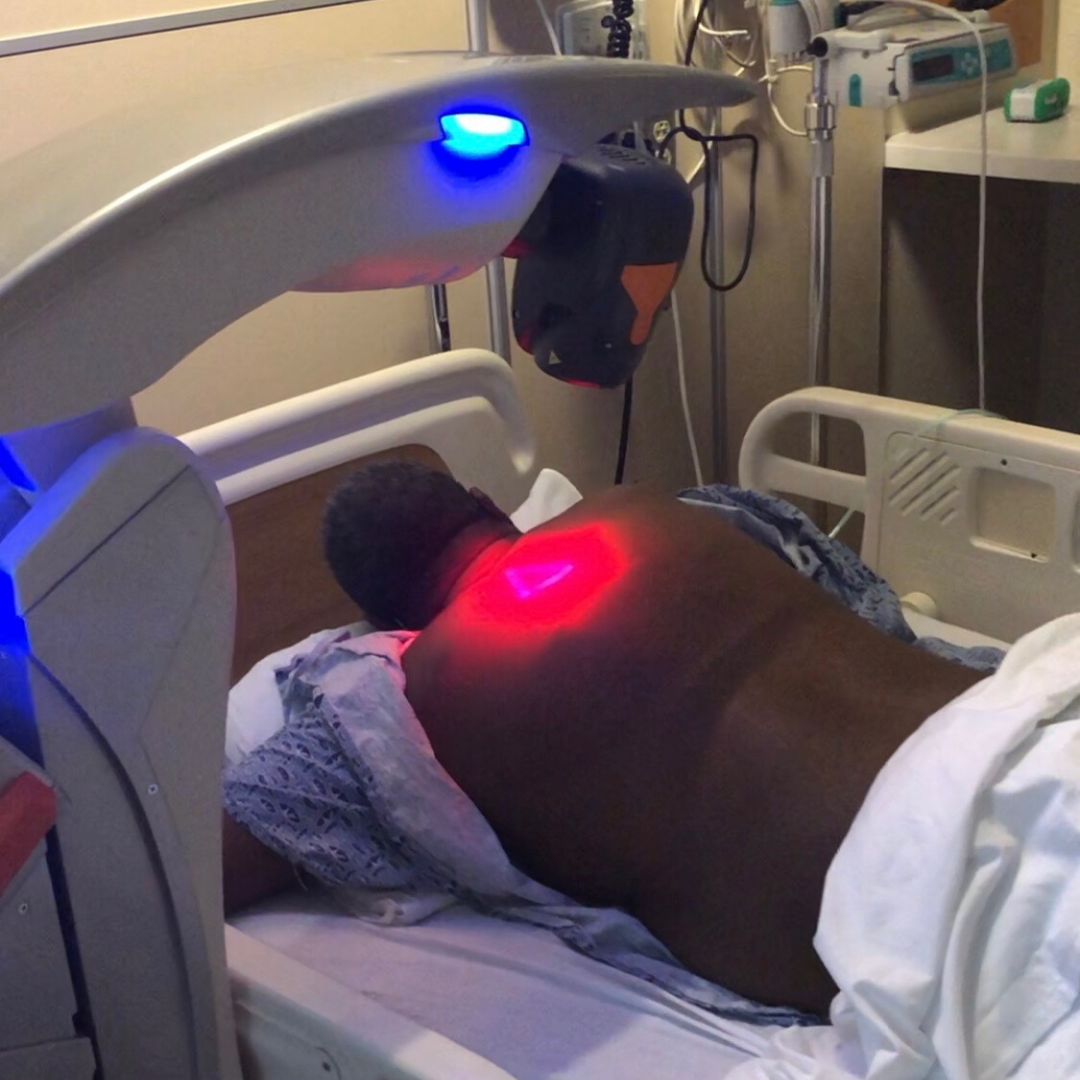
Ein aktuelles Fallbeispiel betreffend die Verwendung der MLS®-Lasertherapie zur Unterstützung eines Patienten, der von einer schweren Lungenentzündung infolge von Covid-19 betroffen war – A 57-Year-Old African American Man with Severe COVID-19 Pneumonia Who Responded to Supportive Photobiomodulation Therapy (PBMT): First Use of PBMT in COVID-19 – zeigte eine deutliche Verbesserung einiger grundlegender Parameter (Atemindices, radiologische Ergebnisse, Sauerstoffbedarf) über mehrere Tage sowie ohne den Bedarf an einem Atemgerät.
Auch wenn noch weitere kontrollierte klinische Studien erforderlich sind, um die Auswirkungen der Lasertherapie auf die klinischen Ergebnisse bei Patienten mit ähnlicher Erkrankung zu untersuchen, ist dieses Fallbeispiel von großer Bedeutung, insbesondere betreffend die kontrollierten Werte.
Die Ergebnisse
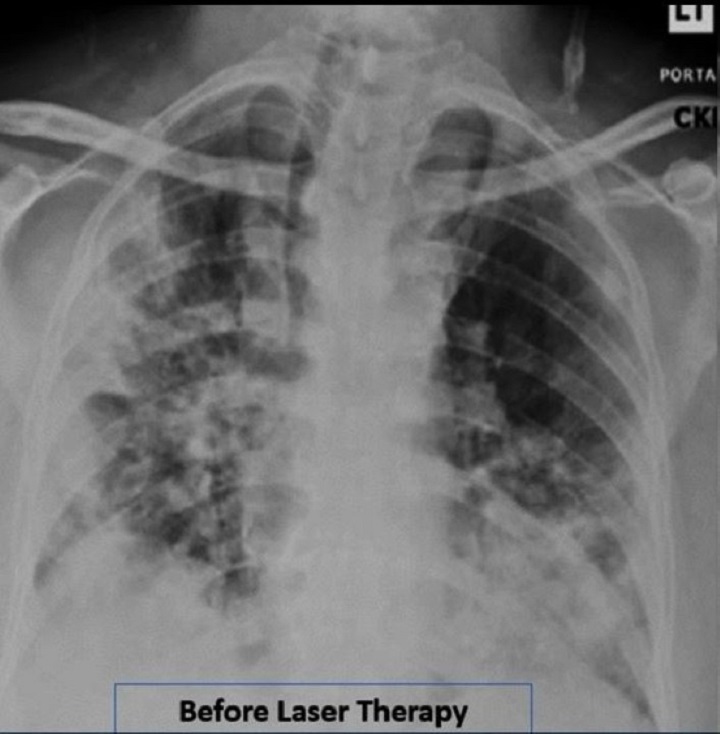
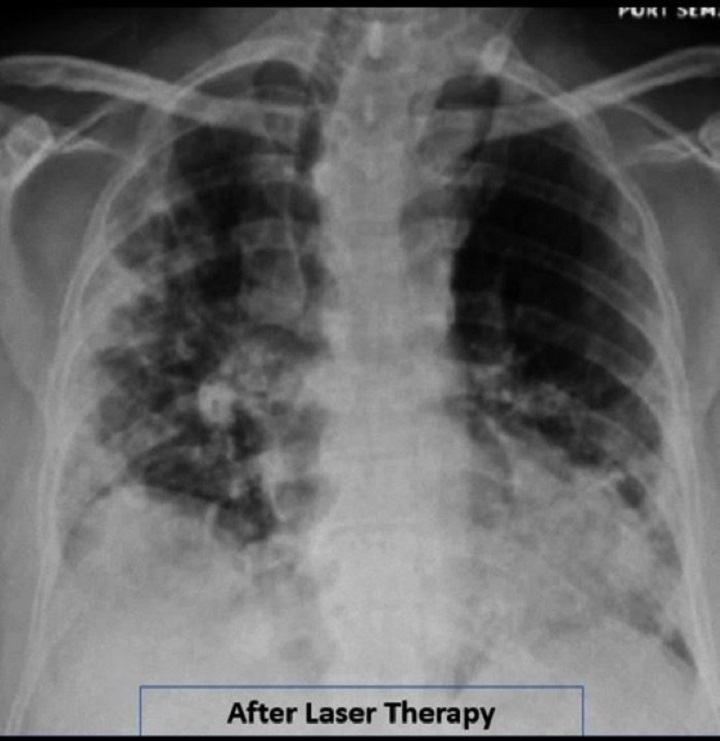
Durch die tägliche Behandlung mit MLS® über 4 Tage konnte beim Patienten tatsächlich eine Steigerung der Sättigung von 93-94 % auf 97-100 %, eine Reduktion des Sauerstoffbedarfs (die abgegebene Menge konnte von 2-4 l/min auf 1 l/min reudziert werden) und eine Verringerung anderer Atemindices (Brescia-COVID und SMART-COP) von 4 auf 0 erzielt werden. Außerdem hat sich das C-reaktive Protein von 15,1 auf 1,23 normalisiert und der CAP Tool Score (ein Fragebogen, mit dem Atemsymptome und Wohlbefinden gemessen werden) hat sich deutlich verbessert.