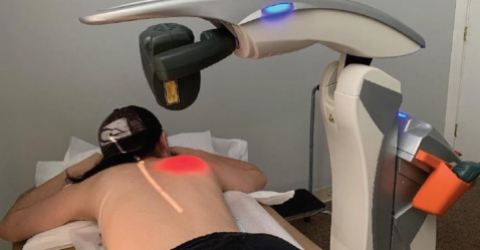
Un nouveau cas clinique confirme l'efficacité de MLS® dans le traitement de la pneumonie COVID-19
De nouvelles études et de nouveaux rapports cliniques témoignent de l'utilité de la thérapie laser MLS® pour aider à traiter les patients atteints de pneumonie COVID-19.
Utilisé comme traitement complémentaire à la thérapie pharmacologique standard, MLS® a pour effet d'atténuer les manifestations inflammatoires aiguës causées par la production excessive de cytokines pro-inflammatoires et favorise la récupération fonctionnelle des poumons.
La preuve en est fournie par une étude de cas récente d'un patient de 70 ans admis à l'hôpital avec des symptômes d'insuffisance respiratoire, de toux, de vomissements et de douleurs thoraciques et des preuves radiographiques de pneumonie atypique COVID-19. Soumis à un traitement médicamenteux combiné à une séance quotidienne de thérapie laser MLS® pendant 5 jours, le patient a montré:
- une augmentation significative du niveau de saturation en oxygène, passé de 90% à 98%;
- une amélioration générale de son état de santé avec régression des symptômes;
- une diminution significative du niveau de ferritine, reconnu comme un marqueur d'inflammation aiguë et chronique.
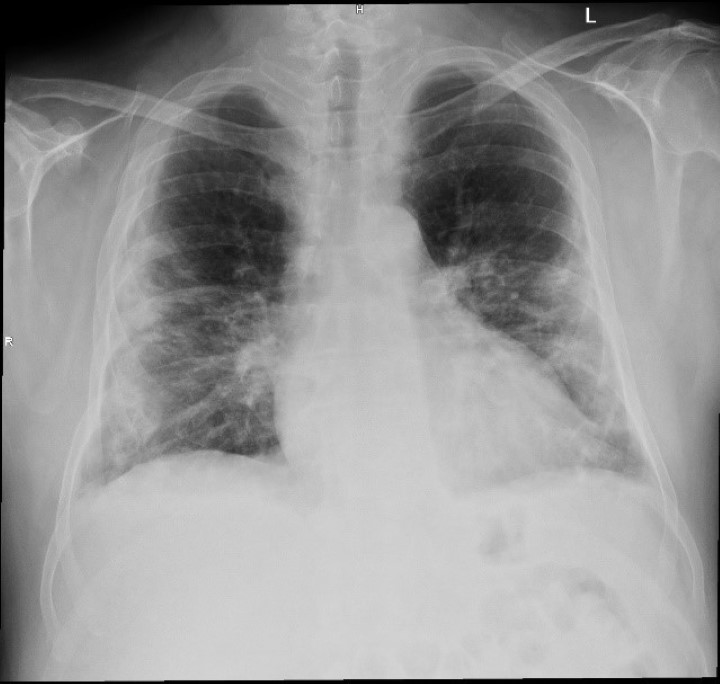
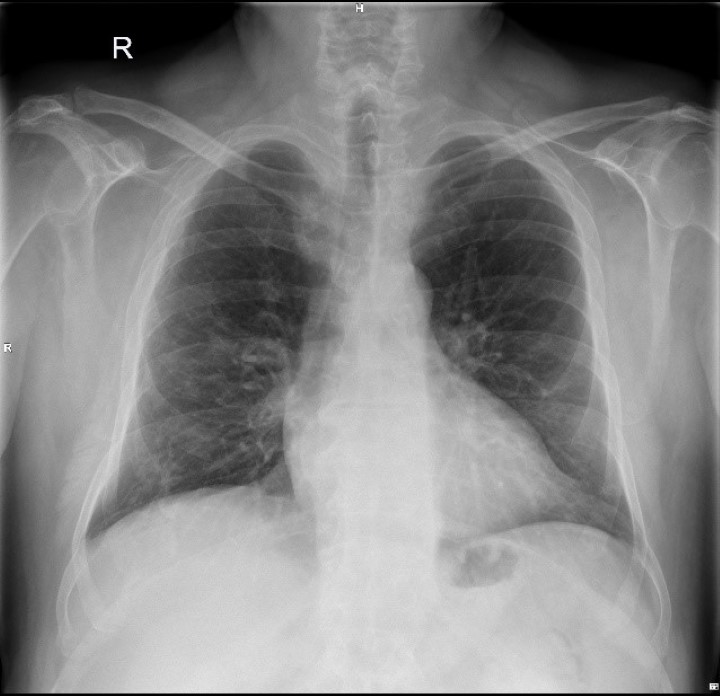
es radiographies du thorax prises avant et après la thérapie au laser avec l'appareil M6 ont également montré une réduction significative de l'inflammation (poumons clairs et dilatés avec diminution des opacités de consolidation). Bien qu'ils ne concernent qu'un seul patient, les résultats de l'étude soutiennent l'utilisation de la thérapie laser MLS® comme aide à la gestion des patients atteints de pneumonie interstitielle.
“Use of the MLS® Laser Therapy in the management of SARS-CoV-2 infection: a case report”
L. Cibulka, V. Petrtýlová
Energy For Health [21], 2021