Train Asa Trainers: 3 Tage Fortbildung
11 April 2024 - Ausbildung -
Anfang April fanden drei Fortbildungstage für die ASA-Trainer aus Lateinamerika und Spanien direkt am Hauptsitz des Unternehmens statt.
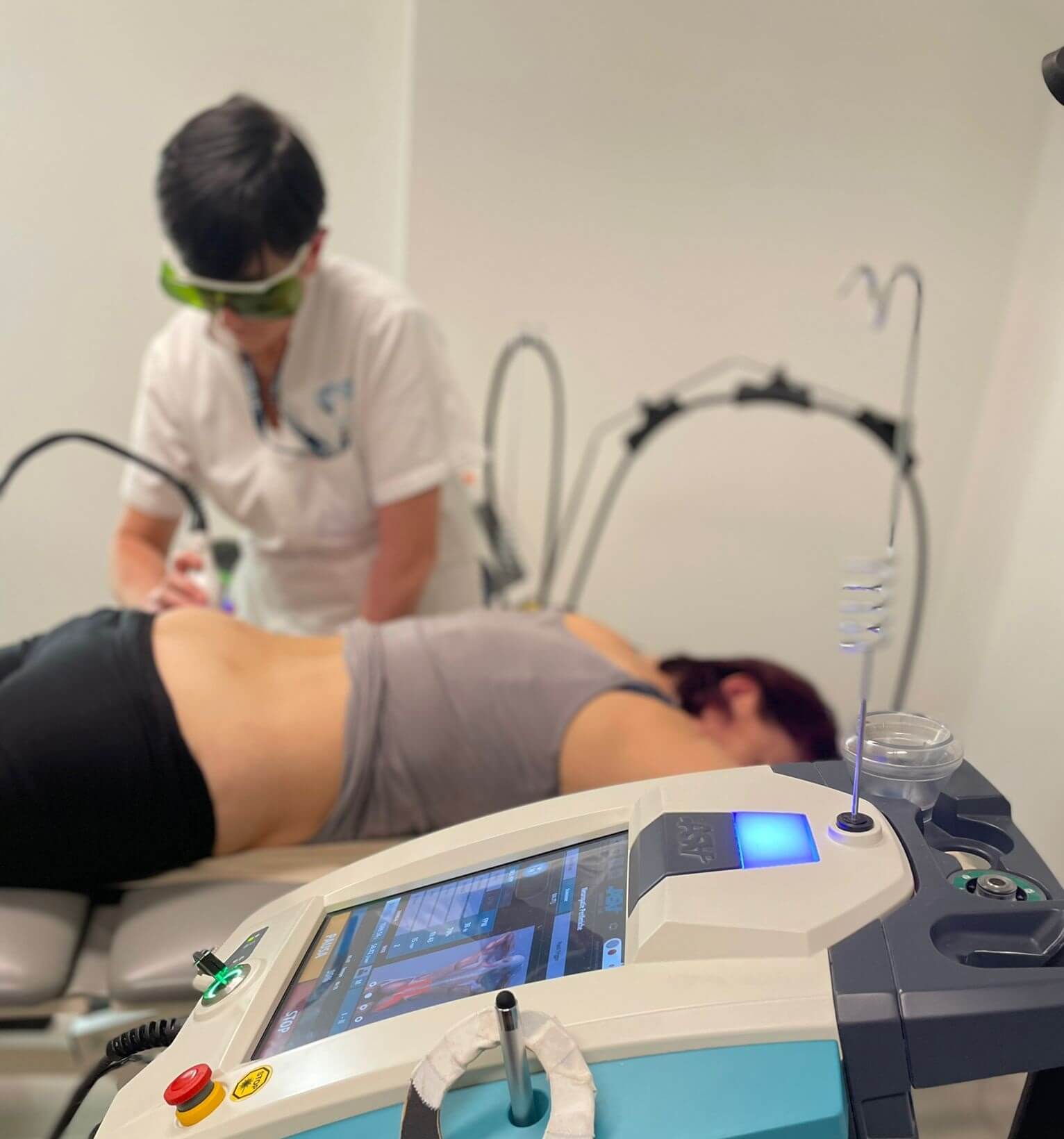
Die Treffen, an denen Monica María Abarca Ulate, Andrés Castañon Mora und Cesar Castaño teilnahmen, bestanden nicht nur aus theoretischen Sitzungen zu Hilterapia®, MLS® -Lasertherapie und Magnetoterpia Qs, die durch klinische Ad-hoc-Studien unterstützt wurden, sondern auch aus eingehenden Studien zu einigen der führenden Geräte wie HIRO TT und MiS.
“Von besonderem Wert war der praktische Teil, der dank der Unterstützung einiger Physiotherapiezentren, die bereits seit einiger Zeit mit unseren Geräten ausgestattet sind, durchgeführt wurde und der es den Teilnehmern ermöglichte, die Wirksamkeit der Therapien und die Spitzentechnologie unserer Systeme in der Praxis zu überprüfen", kommentiert Cinzia Pacini, EMEA Sales Manager ASA.
Testo a Destra
Immagine 60%/Testo 40%
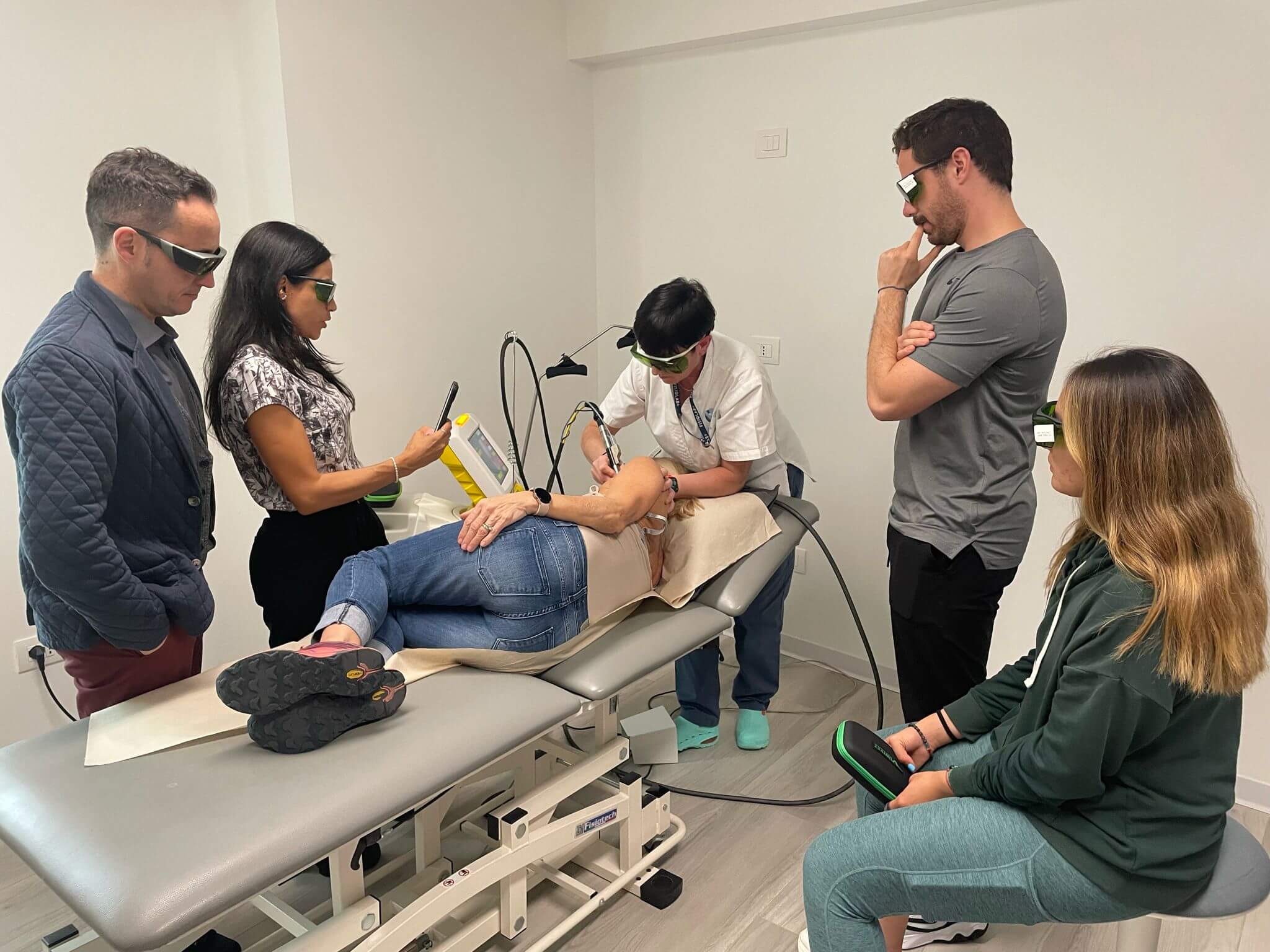
“Die Ziele, die wir uns mit diesem Kurs gesetzt hatten, nämlich unsere Ausbilder auf den neuesten Stand der ASA-Technologien zu bringen und sie mit den neuesten Forschungsergebnissen und wissenschaftlichen Erkenntnissen zu versorgen", unterstreicht Karla Salazar, Area Manager ASA, "wurden weitgehend erreicht. Gleichzeitig ermöglichten diese Praxistage den Teilnehmern, ihre unterschiedlichen Erfahrungen auszutauschen und auf diese Weise ihr Wissen zu erweitern, wodurch ein enges Team entstand”.